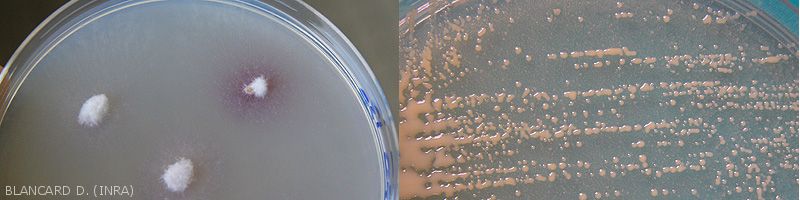
Isolements microbiologiques
- Principe : en fonction du bioagresseur, cela consiste à placer des fragments (ou explants) de tissus végétaux malades, ou une aliquote d’une suspension obtenue à partir de ces derniers sur un ou des milieux de cultures sélectifs* ou non. Ainsi, le bioagresseur suspecté peut se développer, et il sera donc possible de l’isoler, le caractériser, voire l’étudier.
- Bioagresseurs recherchés : champignons, bactéries essentiellement.
- Organes végétaux concernés : tous les organes végétaux.
- Procédure : les échantillons de plantes malades sont souvent lavés et surtout désinfectés avant de réaliser des isolements : flambage à l’alcool, trempage dans des solutions désinfectantes (hypochlorite de calcium ou de sodium, etc.). Par la suite, des fragments de tissus prélevés à la limite des tissus sains et altérés sont prélevés et déposés sur un milieu de culture réparti en boîte de Petri (par exemple sur milieux Malt-agar ou PDA pour les champignons). Pour les bactéries, les fragments sont mis en suspension dans de l’eau stérile et dilacérés, puis une aliquote est déposé sur le milieu de culture (par exemple LPGA) et étalé à l‘aide d’une pipette Pasteur boulée. Dans les heures, voire les jours qui suivent, des colonies mycéliennes se développent progressivement autour des explants, et des colonies bactériennes plus muqueuses apparaissent sur le milieu de culture.
- Identification des champignons : réalisation d'observations à la loupe binoculaire et au microscope photonique.
- Identification des bactéries : mise en oeuvre notamment de tests biochimiques miniaturisés par quelques laboratoires specialisés.
* Des milieux sélectifs sont notamment employés pour les Oomycètes (Pythium spp., Phytophthora spp.), certains champignons et diverses bactéries.





